젬백스앤카엘(대표 김상재)은 알츠하이머병 치료제로 개발 중인 'GV1001'의 국내 3상을 앞두고 있고 일동제약(대표 윤웅섭)도 'ID1201' 국내 3상의 속개를 준비하고 있다. '뉴로스템'의 국내 2a상을 완료한 메디포스트(대표 양윤선)는 임상에서 얻은 유의미한 수치를 기반으로 개발을 이어갈 계획이다.
치매는 다양한 원인 질환으로 인지기능 저하를 보이는 일종의 증후군이다. 전세계 급속한 고령화로 치매 환자는 갈수록 증가하고 있으나 근본적으로 치매를 치료하는 약제는 아직 없다. 도네페질, 라바스티그민, 갈란타민, 메만틴 등 시중에 나온 치매 약제는 증상 진행을 늦추는 수준에 지나지 않는다.
이런 이유로 다국적 제약사들은 수년간 수조 원을 들여 치매 치료제 개발을 주도해왔으나 임상 3상 단계에서 번번이 좌절을 맛봤다. BACE(베타 세크레타제 절단효소) 억제제 계열 약물들이 줄줄이 실패했고 기대를 모았던 로슈의 크레네주맙 또한 3상을 중단했다.
바이오젠과 에자이가 공동 개발하고 있는 아두카누맙은 현지시간 6일 미국 FDA(식품의약품) 약물자문위원회(PCNS)로부터 부정적인 의견을 받는 등 승인 여부가 불투명한 상황이다.
국내에서는 젬백스앤카엘, 일동제약, 메디포스트, 아리바이오(대표 정재준), 디앤디파마텍(대표 이슬기), 바이오오케스트라(대표 류진협·조현정), 차바이오텍(대표 오상훈) 등이 치매 치료제를 개발하고 있는 것으로 알려졌다.
젬백스앤카엘은 텔로머라제(Telomerase)에서 유래한 16개 아미노산으로 구성된 펩타이드 약물 'GV1001'을 알츠하이머병 치료제로 개발하고 있다.
앞서 지난해 12월 젬백스앤카엘은 GV1001 국내 2상 결과 1차 평가변수인 중증장애점수(SIB, 중등도 이상의 치매 평가검사)에서 대조군 대비 월등한 개선 효과를 보였고 2차 목표인 신경정신행동검사(NPI), 알츠하이머병 일상생활 수행능력평가(ADCS-ADL) 등에서 탁월한 유의성을 확인했다고 발표했다.
이 결과를 기반으로 젬백스 측은 국내 3상 진입을 위해 임상승인신청서(IND)를 제출 준비하고 있다. 미국 2상도 승인받았으나 코로나19 팬데믹으로 일정이 다소 지연되고 있는 것으로 알려졌다.
젬백스앤카엘 관계자는 "미국 2상의 경우 현지와 소통해 최대한 빠르게 진입할 예정"이라며 "미국 식품의약국(FDA)로부터 2상에 대한 적응증 확대 제안을 받아 이미 허가 받은 중등도 이상의 알츠하이머병 환자 대상 임상 외에 경증 알츠하이머병과 경도인지장애까지 적응증을 확대한 임상승인을 신청할 계획"이라고 말했다.
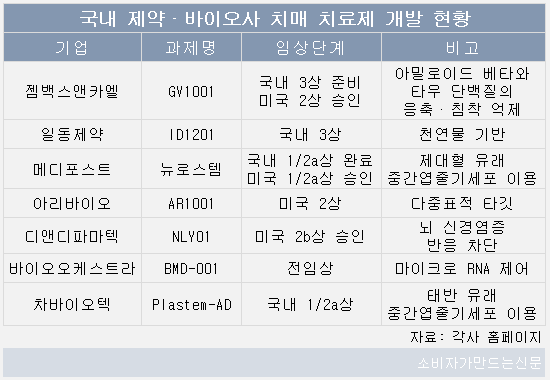
일동제약이 치매 신약으로 개발 중인 천연물 기반의 'ID1201'도 3상 개시를 앞두고 있다. ID1201은 멀구슬나무 열매인 천련자 추출물을 주성분으로 하는 치매신약으로 알파세크레타아제라는 효소를 촉진해 베타아밀로이드 생성을 억제하고 신경세포를 보호하는 기전을 가지고 있다.
ID1201 2상은 26개 의료기관 환자 100명 규모로 2014년 시작해 지난해 4월 종료됐는데 결과 데이터가 목표치에 도달한 것으로 알려졌다. 지난해 8월 경증 알츠하이머병 환자 1449명을 대상으로 한 대규모 3상 임상시험을 승인받았다.
일동제약 관계자는 "3상이 중단된 것은 아니며 준비하고 있는 상황이다. 의료기관 선정, 대상자 모집 등 임상시험을 위한 준비 절차를 밟고 있다"고 말했다. 임상 개시 가능성은 열려있다는 설명이다.
메디포스트는 제대혈 유래 중간엽줄기세포를 이용한 '뉴로스템'을 알츠하이머성 치매 치료제로 개발하고 있다. 2013년 9월 국내 1·2a상 승인을 받았고 올해 1월 시험이 종료됐다. 임상 결과 1차 유효성 평가변수인 ADAS-Cog의 변화량 평가변수에서 위약군과 뉴로스템군간 통계적 유의성을 확인하지 못했다.
이에 대해 메디포스트 측은 임상에서 얻은 다양한 데이터에서 일부 가능성을 확인했다고 설명했다. 뇌척수액에서 아밀로이드 베타 단백질과 타우 단백질 수치 등이 감소했고 투여 후 24주째 관찰에서도 아밀로이드 침착이 위약군 대비 감소하는 경향을 보였다.
메디포스트는 임상 데이터 결과를 재분석해 치매 치료제 가능성을 재확인할 계획이다. 메디포스트 관계자는 "예상 치료효능물질 분비가 증가되는 소견을 확인했으나 비교적 짧은 임상시험 기간 내에 인지기능개선 유무를 확인하기는 힘들었다. 추후 적절한 질병 단계 및 평가기간 설정, 효능 강화 등을 보완해 치매 치료제 개발을 진행할 계획"이라고 말했다.
이 외 아리바이오가 개발 중인 알츠하이머 신약 후보물질 'AR1001'은 미국 2상을 진행하고 있다. AR1001은 알츠하이머 발병과 관련된 여러 원인을 동시 억제하는 다중 기전을 가지고 있다. 회사에 따르면 2상 전반부 시험에서 환자 60%의 인지능력이 지속 향상되는 긍정적 결과가 나타났다.
디앤디파마텍이 개발하고 있는 NLY01은 지난 2일 미국 FDA로부터 2b상 IND를 승인받았다. 2상은 알츠하이머성 치매 환자 518명 대상으로 100개 이상의 기관에서 진행된다. NLY01은 신경염증 반응의 근본 원인이 되는 미세아교세포 활성화를 억제하고 성상교세포의 과활성화 과정을 선택적으로 차단해 신경 독성물질의 분비를 막는 기전을 가진다.
바이오오케스트라의 대표 파이프라인이자 신약 개발 플랫폼인 BMD(바이오오케스트라 다중 메신저 RNA 조절인자 치료제) 기술로 발굴한 BMD-001은 전임상 단계에, 차바이오텍의 태반 유래 중간엽줄기세포를 이용한 Plastem-AD는 국내 1·2a상 단계를 밟고 있다.
[소비자가만드는신문=김경애 기자]




