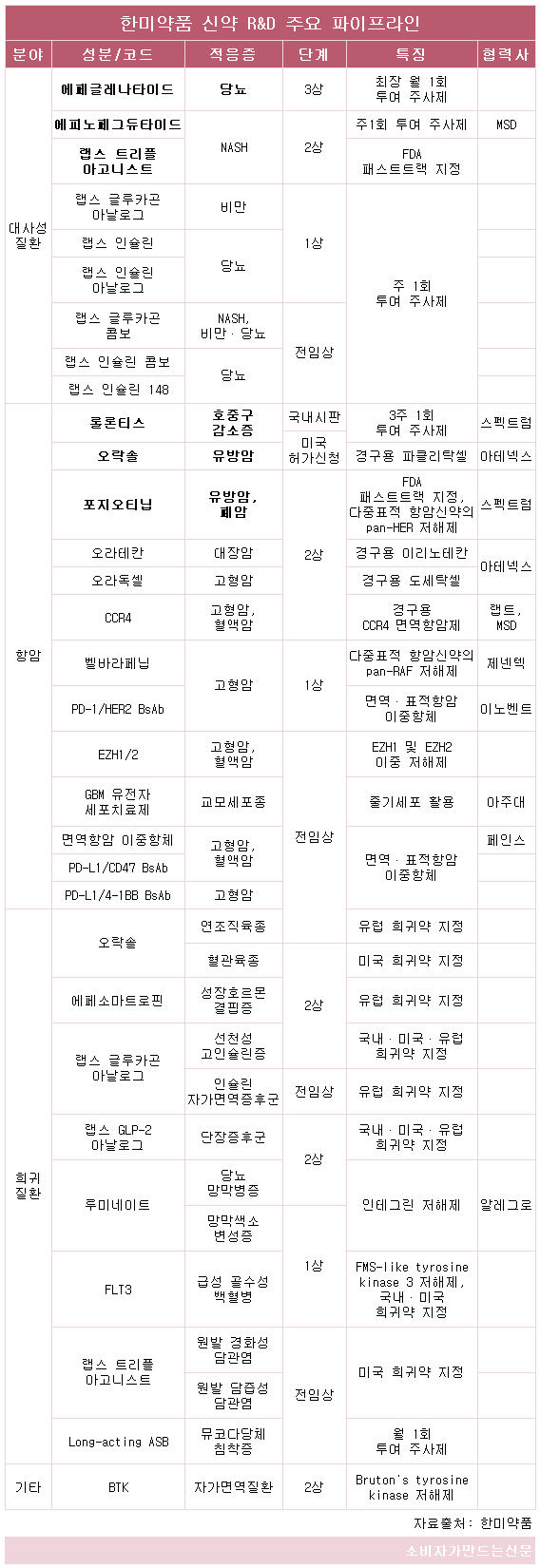
현재 2상과 3상 단계에 있는 한미약품의 신약 후보물질들은 미충족 수요(Unmet Need)와 높은 시장성을 앞세워 출격 채비를 갖추고 있는 것으로 알려졌다.
한미약품의 파트너사 스펙트럼 파마슈티컬(Spectrum Pharmaceuticals)은 항암 혁신신약(First in Class) '포지오티닙(pan-HER)'의 신약 시판허가를 올해 말 FDA(미국 식품의약품청)에 신청할 예정이다.
포지오티닙은 2012년 스펙트럼에 기술 수출됐으며 지난 달 FDA 패스트 트랙(Fast Track)으로 지정됐다. 오는 10일(현지시간)에는 미국암연구학회(AACR)에서 EGFR과 HER2 엑손(exon) 20 돌연변이 비소세포폐암(NSCLC) 환자 대상으로 진행된 2상의 주요 데이터를 공개한다.
국내 시판허가를 받은 롤론티스는 지난 2015년 스펙트럼에 기술 이전된 데 이어 올해 안에 FDA 시판허가가 이뤄질 것으로 보인다. 롤론티스는 독자 플랫폼 기술인 '랩스커버리(LapsCovery)'가 적용된 바이오 신약으로, 지난 달 33호 국산신약으로 시판 허가를 받았다.
경구용 전이성유방암 신약 '오락솔'도 FDA 시판허가를 앞두고 있다. 이 외 당뇨 신약 '에페글레나타이드(Laps Exd4 Analog)'는 글로벌 3상, NASH(non-alcoholic steatohepatitis, 비알코올성 지방간염) 신약 '에피노페그듀타이드(Laps GLP/GCG Analog)'와 'HM15211(Laps Triple Agonist)'은 글로벌 2상 단계에 있다.
한미약품은 독자 플랫폼 기술인 랩스커버리(LapsCovery)가 적용된 호중구 감소증 신약 '롤론티스(Rolontis)®'(성분명: 에플라페그라스팀)로 올해 첫 연구개발 성과를 냈다.
'롤론티스'는 항암화학요법을 받는 환자의 호중구감소증 치료 또는 예방 용도로 투여되는 약효 지속형 바이오 신약이다. 2012년 스펙트럼에 라이선스 아웃됐으며 지난 달 18일 식품의약품안전처로부터 33호 국산신약으로 시판허가를 받았다.
한미약품은 2019년 10월 FDA에 바이오의약품 품목허가 심사(Biologics License Application, BLA)를 신청했으나 코로나19로 인한 미국 공무원 여행 제한 조치로 제조시설(평택 바이오플랜트) 실사 일정이 잠정 연기됐었다.
FDA 실사는 미국 시판허가를 위한 마지막 단계로, 오는 5월 중으로 진행된다. 한미약품은 실사 준비에 만전을 기해 올해 안으로 시판 허가를 획득할 계획이다.
다중 표적 항암신약 '포지오티닙(Poziotinib)'은 pan-HER 억제제다. 스펙트럼은 2012년 한미약품으로부터 유망 신약 후보물질 중 하나인 포지오티닙을 도입해 2015년부터 글로벌 2상을 진행하고 있다.
포지오티닙은 EGFR 및 HER2 엑손20 돌연변이 비소세포폐암 치료제로 지난 달 FDA로부터 패스트 트랙으로 지정됐다. 패스트 트랙은 중요한 신약을 조기 공급하기 위한 목적으로 FDA가 시행하는 절차인데, 우선순위 검토를 통해 시판허가 신청 리뷰 기간이 10개월에서 6개월로 단축된다.
스펙트럼은 이 기세를 몰아 올해 말 FDA에 신약 시판허가를 신청할 예정이다. 한미약품은 FDA 허가 시 15조 원 규모 비소세포폐암 시장에 진출하는 것은 물론 글로벌 신약 라인업도 강화할 수 있게 된다.
경구용 파클리탁셀 '오락솔(Oraxol)®'은 전이성 유방암 등 고형암을 적응증으로 FDA 시판허가를 기다리고 있다.
2011년 아테넥스(Athenex)에 487억 원 규모로 기술 이전됐으며 2018년과 2019년 FDA와 EMA(유럽 의약품청)로부터 희귀의약품으로 지정받았고, MHRA(영국 의약품 보건의료제품 규제청) 유망혁신치료제(PIM)로도 지정받았다. 지난해 9월에는 FDA 우선심사(Prioirty Review) 대상으로 지정되기도 했다.
다만 오락솔은 지난 달 1일(현지시간) FDA로부터 시판허가에 대한 보완요구 서한(CRL, Complete Response Letter)을 받아 허가 일정이 다소 지연될 것으로 보인다.
오락솔이 FDA 시판허가를 받게 되면 한미약품은 아테넥스로부터 약 284억 원의 마일스톤과 순매출에 따른 로열티를 지급받게 된다. 파클리탁셀 글로벌 시장 규모는 약 2조 원(아이큐비아 기준)으로 알려져 있다.
GLP-1 계열의 당뇨 바이오 신약 '에페글레나타이드'는 같은 약리기전을 가진 치료제 중 가장 우수한 'Best in Class'로 개발되고 있다. 올해 초 글로벌 3상(Amplitude-M)을 완료했다.
한미약품에 따르면 모든 용량의 코호트에서 위약 대비 30주 당화혈색소(HbA1c) 감소에 성공해 1차 평가변수(Primary end point)를 충족했다. 2차 평가변수인 체중 감소 효과도 확인했다. 회사는 비만 신약 후보물질 '랩스 글루카곤 아날로그(Laps Glucagon Analog)' 등 여러 약물과 조합해 치료 효과를 극대화할 계획이다.
NASH 혁신신약 '에피노페그듀타이드(Laps GLP/GCG Analog)'는 올해 글로벌 2상에 진입했다. 인슐린 분비와 식욕 억제를 돕는 GLP-1 수용체와 에너지 대사량을 증가시키는 글루카곤을 동시 활성화하는 이중 작용제로 랩스커버리 기술이 적용됐다.
에피노페그듀타이드는 2015년 얀센에 비만·당뇨 신약 후보물질로 기술 수출됐으나 적응증을 두고 양사간 이견을 보이면서 권리가 반환됐다. 한미약품은 적응증을 NASH로 변경하고 지난해 8월 MSD에 1조 원 규모로 라이선스 아웃 계약을 새롭게 체결했다.
바이오 신약 '랩스 트리플 아고니스트'도 NASH 혁신신약으로 개발되고 있다. NASH는 간에 지방이 쌓이면서 염증과 간손상을 일으키는 질환으로 현재 시판된 치료제가 없어 미충족 수요가 높은 미개척 시장으로 꼽힌다. 시장 규모는 2026년 기준 약 28조 원까지 커질 것으로 전망된다.
랩스 트리플 아고니스트는 단일 타겟 경구 치료제 한계를 극복하는 삼중(Glucagon, GIP, GLP-1) 작용제로, 현재 미국 2상 단계에 있다. 지난해 FDA로부터 원발담즙성담관염과 원발경화성담관염 희귀의약품으로 각각 지정받았고 FDA 패스트트랙으로도 지정받았다.
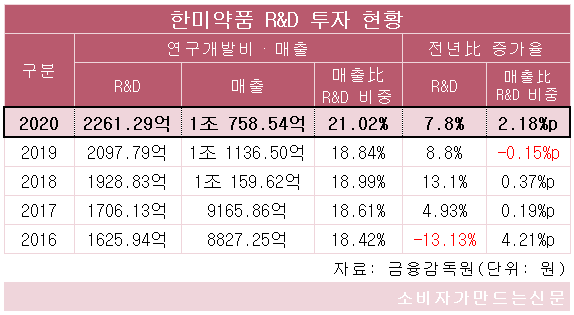
회사의 지난해 연구개발비는 2261억 원으로 전년에 비해 7.8% 늘었다. 매출 대비 연구개발 비율은 21%로 국내 제약사 중 가장 높은 비율을 기록하고 있다.
한미약품 관계자는 "자사는 30여 개 파이프라인 가치 중대를 위해 매년 높은 비중의 R&D 투자를 유지해오고 있다"면서 "탄탄한 전문의약품 브랜드를 바탕으로 얻은 수익을 다시 혁신신약을 위해 투자하는 선순환 구조를 정착시켜 지속 가능한 미래가치를 창조해 나가겠다"고 말했다.
[소비자가만드는신문=김경애 기자]



