해당 프로그램은 연구개발·임상승인·허가심사·정보공유·국제공조에 이르기까지 단계별 시행착오를 최소화해 개발 기간을 단축하는 게 주된 내용이다.
기존에 사용 중인 의약품의 코로나19 치료 효과를 확인하기 위한 '약물 재창출' 관련 임상시험은 늦어도 7일 이내에 심사를 완료할 계획이다.
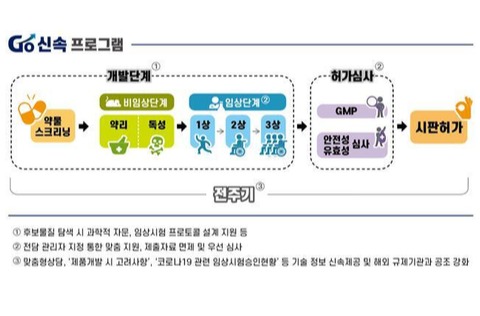
코로나19 치료 효과를 기대할 수 있는 품목에 대해서는 전담관리자를 지정해 연구개발부터 허가심사 등 단계별로 지원하기로 했다.
또 안전성이 입증된 플랫폼으로 개발한 백신은 독성시험을 면제하는 등 자료 제출도 최소화해 조기에 임상시험에 진입할 수 있도록 도울 방침이다.
사용 경험이 있는 물질의 경우 7일 이내로, 신물질의 경우 15일 이내로 임상시험 심사 기간을 단축하기로 했다. 허가 시에도 우선해 처리할 예정이다.
이 밖에 의약품 규제기관 국제 연합(ICMRA) 등 국제적 공조를 통해 각국에서 진행되는 임상시험 및 심사정보를 공유하기로 했다.
[소비자가만드는신문=김민희 기자]
저작권자 © 소비자가 만드는 신문 무단전재 및 재배포 금지



