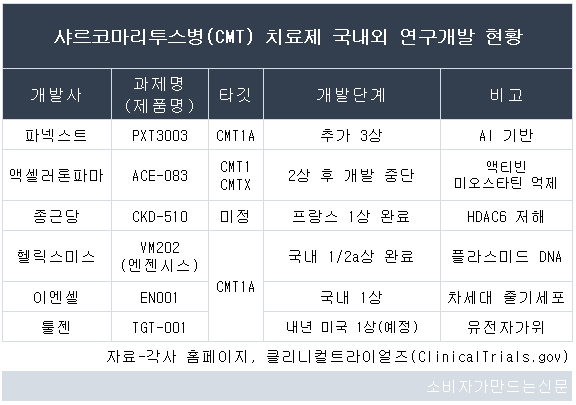
종근당(대표 김영주)은 CKD-510의 프랑스 1상을 마무리하고 미국 2상 진입을 앞두고 있다. 헬릭스미스도 VM202(제품명: 엔젠시스)의 국내 1/2a상을 완료하고 지난해 11월 탑라인(Topline)을 발표했다. 두 물질 모두 임상에서 긍정적 결과를 얻은 것으로 알려져 연내 후속 임상에 진입할 것으로 기대를 모으고 있다.
샤르코마리투스병은 수십여 종류의 유전자 변이로 발생하는 가장 일반적인 유전성 신경병증이다. 운동·감각신경이 점진적으로 손상돼 팔과 다리 근육이 약화되면서 보행 장애가 발생한다.
2500명 중 1명 꼴로 발생하며 희귀·난치성 질환 중 환자 수가 가장 많다. 전 세계 280만 명의 환자가 있으며 미국에만 12만 명이 넘는 환자가 분포한다. 국내에는 약 1만7000명가량이 있다. 그러나 근본적 치료제가 아직 개발되지 않아 근육강화제나 진통제, 변형교정 수술, 재활치료 등의 보조 요법이 사용된다.
유전 양상에 따라 상염색체 우성유전을 하는 CMT1과 CMT2, 상염색체 열성유전을 하는 CMT4, X염색체 연관 유전을 하는 CMTX 등으로 타입이 구분된다. 이 중 1형인 CMT1는 보고된 순서에 따라 1A와 1B, 1C로 구분되는데 1A는 국내외 통틀어 전체의 약 40%를 차지할 정도로 환자 비중이 크다.
프랑스 파리에 본사를 둔 제약사 파넥스트(Pharnext)가 개발하는 PXT3003도 CMT1A를 타깃으로 하는데, 임상단계만 놓고 보면 PXT3003가 전 세계 후보물질 중 가장 앞선 것으로 파악된다. 지난해 3월 350명을 대상으로 추가 3상에 진입했다.
국내에서는 종근당(대표 김영주)과 헬릭스미스(대표 김선영·유승신), 이엔셀(대표 장종욱), 툴젠(대표 김영호·이병화) 등이 샤르코마리투스병 치료제를 개발 중이다.
이 중 종근당이 개발하는 CKD-510는 국내사에서 보유한 샤르코마리투스병 신약 후보물질 중 임상이 가장 앞선 단계로 평가받는다. 2019년 9월 프랑스에서 1상을 승인받아 안전성과 유효성을 확인, 올해 1분기 시험을 완료했다.
최근에는 FDA(미국 식품의약국)와 Pre-IND(Pre-Investigational New Drug) 협의를 마친 것으로 알려져 늦어도 올해 안에 글로벌 2상에 진입할 것으로 기대를 모으고 있다.
종근당 관계자는 "샤르코마리투스병은 희귀질환 중에서도 환자 수가 많은 질환이지만 아직까지 허가된 약이 없다. 또 치료제가 하나 나왔다고 해서 그 약이 시장을 완전히 장악할 수 있는 것도 아니다. 글로벌 임상을 계획대로 진행해 국내외 시장을 함께 노릴 계획"이라고 말했다.
헬릭스미스도 대표 약물인 VM202(엔젠시스)를 샤르코마리투스병 1A 치료제로 개발하고 있다. 2020년 4월 식품의약품안전처로부터 1/2a상을 승인받아 지난해 말 임상을 마무리하고 탑라인(Topline) 데이터를 발표했다.
헬릭스미스에 따르면 1/2a상에서 안전성은 물론 FDS(Functional Disability Scale, 기능장애척도)와 ONLS(Overall Neuropathy Limitation Scale, 전반적 신경장애 한계 척도), CMTNS-v2(CMT 신경병 점수 v2)에서 일부 감각증상의 개선 등이 확인됐다.
헬릭스미스 김선영 대표가 "다음 임상에서는 임상의 규모를 늘리고 증세가 진전된 환자를 선정해 효과를 보다 명확하게 측정할 수 있을 것"이라고 언급한 만큼 차기 임상 진입에 속도가 붙을 것으로 예상되고 있다.
이엔셀도 샤르코마리투스병 1A를 타깃으로 하는 차세대 줄기세포 치료제 EN001 임상 개발을 진행하고 있다. 2020년 말 식약처에 IND(임상시험계획)를 제출해 지난해 6월 국내 1상에 진입했다.
이엔셀 측은 1상을 향후 개발단계 희귀의약품 지정 신청과 2상 진입 근거로 활용하고, 2상 종료 후에는 조건부 허가를 추진해 오는 2025년 제품을 출시하겠다는 각오를 내세웠다.
크리스퍼(CRISPR) 유전자가위 기술로 유명한 툴젠도 TGT-001을 1A를 타깃으로 하는 샤르코마리투스병 치료제로 개발 중이다.
이병화 툴젠 대표는 지난해 11월에 열린 글로벌 바이오포럼 2021(GBF 2021) 기업IR에서 TGT-100 미국 1상을 내년 안으로 개시하겠다고 발표한 바 있다. TGT-001은 자체 플랫폼 기술인 크리스퍼 카스9을 활용해 개발되고 있다. 이 기술은 살아있는 세포에서 원하는 유전체 위치를 잘라 유전 정보를 바꿀 수 있는 기술이다.
글로벌 최대 비영리 지원 재단인 CMTA(Charcot-Marie-Tooth Association)와 샤르코마리투스병 치료제 TGT-001 임상 진입을 위한 파트너쉽도 구축했다. 이를 기반으로 연내 FDA에 IND를 신청한다는 계획이다.
[소비자가만드는신문=김경애 기자]



